非金属性强弱判断依据_非金属性
1、由元素原子的氧化性判断:一般情况下,氧化性越强,对应非金属性越强。
 (资料图)
(资料图)
2、2、由单质和水生成酸的反应程度判断:反应越剧烈,非金属性越强。
3、3、由对应氢化物的稳定性判断:氢化物越稳定,非金属性越强。
4、4、由和氢气化合的难易程度判断:化合越容易,非金属性越强。
5、5、由最高价氧化物对应水化物的酸性来判断:酸性越强,非金属性越强。
6、值得注意的是:氟元素没有正价态,故没有氟的含氧酸,所以最高价氧化物对应水合物的酸性最强的是高氯酸,而不是非金属性高于氯的氟元素!故规律5只适用于氟元素之外的非金属元素。
7、6、由对应阴离子的还原性判断:还原性越强,对应非金属性越弱。
8、7、由置换反应判断:强置弱。
9、〔若依据置换反应来说明元素的非金属性强弱,则非金属单质应做氧化剂,非金属单质做还原剂的置换反应不能作为比较非金属性强弱的依据〕8、按元素周期律,同周期元素由左到右,随核电荷数的增加,非金属性增强;同主族元素由上到下,随电子层数的增加,非金属性减弱。
10、元素的非金属性是元素化学术语的一种,非金属性常表示获得电子的倾向。
11、元素的非金属性包括很多方面:元素的原子得电子的能力,氢化物的稳定性,最高价氧化物水化物酸性强弱等·它包含了原子得电子的能力(氧化性),但比氧化性的含义更为广泛。
12、元素的非金属性主要按照其电负性的强弱。
13、对于元素来说,元素的电负性常数越大,则其非金属性越强,但此为一般情况下,具体情况仍需具体分析。
14、非金属元素非金属性强弱:F>O>Cl>N>Br>I>S>C>Se>At>H>P>As>Te>B>Si。
本文分享完毕,希望对你有所帮助。
关键词:
精心推荐
- 全国首批!广州市获批开展外籍“高精尖缺”人才认定标准试点工作
- 比利时市场调查显示超七成零售商对前景担忧
- 观察:12月29日基金净值:广发创新升级混合最新净值2.7602,跌0.21%
- 2023金华双龙旅游景区跨年敲钟祈福仪式_世界热文
- 一镜到底穿越2022
- 2023中国长春净月潭瓦萨国际滑雪节开始时间 世界观速讯
- 深圳坪山云巴 1 号线通车:最高时速 80km / h,采用无人驾驶技术 全球热讯
- 世界观点:量子思维(08050.HK)认购180万元理财产品
- 热点在线丨对友情绝望的句子精选316句
- 西安儿童医院发热门诊就诊须知
- 政府补贴助推上海快递业火爆:配送员找亲友帮忙送单,有外卖员日赚千元
- 机器学习数据不满足同分布,怎么整? 环球播报
- 保定市涞水县交通违章可以在网上办理吗
- 天天头条:中信证券: 中信证券股份有限公司第七届董事会第四十八次会议决议公告
-

新华网科伦坡12月27日电(记者车宏亮)马累消息:中马友谊赛跑近日在马尔代夫首都马累市中马友谊大桥上举行,中国驻马大使王立新、马青体部长
-

华东医药(000963)12月27日在投资者关系平台上答复了投资者关心的问题。
-

中新网西宁12月26日电(李隽)26日,记者从青海省人民政府获悉,该省将碳达峰碳中和纳入经济社会发展和生态文明建设整体布局,从供给、消费、固
-

华天酒店12月26日主力资金净流入9353 70万元,涨跌幅为7 76%,主力净量(dde大单净额 流通股)为1 54%,两市排名25 4897。投顾分析华天酒店今日
-

12月25日,国联证券发布一篇非银金融行业的研究报告,报告指出,建议低位布局非银板块,静候风险偏好回升。 报告具体内容如下: 投资要
X 关闭
X 关闭
产业
-
不用跑北京 在家门口也能挂上顶...
日前,我省首个神经疾病会诊中心——首都医科大学宣武医院河北医院...
-

“十四五”期间 河北省将优化快...
从省邮政管理局获悉,十四五期间,我省将优化快递空间布局,着力构...
-

张家口市宣化区:光伏发电站赋能...
3月19日拍摄的张家口市宣化区春光乡曹庄子村光伏发电站。张家口市宣...
-
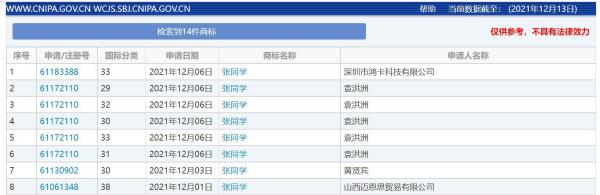
“张同学”商标被多方抢注 涉及...
“张同学”商标被多方抢注,官方曾点名批评恶意抢注“丁真” ...
-

山东济南“防诈奶奶团”花式反诈...
中新网济南12月15日电 (李明芮)“老有所为 无私奉献 志愿服...
-

广州新增1例境外输入关联无症状...
广州卫健委今日通报,2021年12月15日,在对入境转运专班工作人...
-

西安报告初筛阳性病例转为确诊病例
12月15日10:20,经陕西西安市级专家组会诊,西安市报告新冠病毒...
-
广东东莞新增本土确诊病例2例 ...
(抗击新冠肺炎)广东东莞新增本土确诊病例2例 全市全员核酸检测...
-

中缅边境临沧:民警深夜出击捣毁...
中新网临沧12月15日电 (胡波 邱珺珲)记者15日从云南临沧边境...
-

“土家鼓王”彭承金:致力传承土...
中新网恩施12月15日电 题:“土家鼓王”彭承金:致力传承土家...
